Ученым из Института математических проблем биологии РАН совместно с возглавляемой Сюзанной Андраде группой ученых из Университета Фрайбурга (Германия), а также с коллегами из Европейской молекулярно-биологической лаборатории в Гамбурге (Германия) и Университета Неймегена (Нидерланды) удалось установить структуру необычной сигнальной системы, присутствующей в анаммокс-бактериях.
Результаты исследования опубликованы в журнале NatureCommunications.
Анаммокс-бактерии были открыты в самом конце XXвека и быстро нашли применение в промышленных системах очистки сточных вод от азотного загрязнения, возникающего в результате широкого использования в сельском хозяйстве азотных удобрений.
Это применение основано на удивительном свойстве анаммокс-бактерий - их способности поглощать ионы аммония и нитрита, превращая их в воду и молекулярный азот, являющийся основным компонентом земной атмосферы. Они способны осуществлять превращения даже при очень низкой концентрации аммония. При этом, процесс преобразования происходит в бескислородной среде, то есть, не требуя расхода кислорода.
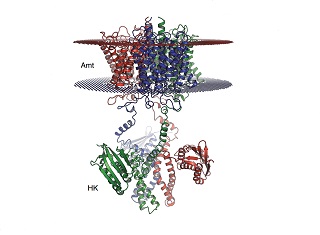
Бактерия лишена органов чувств. Каким образом она находит аммоний в окружающей среде? Передача сигнала через внешнюю оболочку клетки — один из важнейших вопросов современной биологии. Понимая механизмы передачи сигнала, можно научиться управлять такими бактериями. Ученых заинтересовал необычный белок, обнаруженный в одном из видов анаммокс-бактерий. Последовательность аминокислот этого белка содержала необычную комбинацию двух разнотипных частей. Первая часть была похожа на структуру трансмембранных белков, которые пронизывают клеточную мембрану насквозь и передают ионы аммония внутрь клетки.
Вторая часть напоминала белки гистидин-киназы. Эти белки часто присутствуют в системах передачи сигнала из наружной среды внутрь клетки. Передача сигнала представляет собой цепь последовательных биохимических реакций. У данной молекулы поступление сигнала шло посредством фосфорилированием гистидина, т.е. присоединением к боковой цепи гистидина остатка фосфорной кислоты.
Исследователями была выдвинута гипотеза, что обнаруженный двухкомпонентный белок является средством передачи внутрь клетки сигнала о наличии аммония во внеклеточной среде. Эта гипотеза была подтверждена в процессе исследования.
Ученые установили, что трансмембранная часть белка бактерии не имеет транспортных функции. Она не передает аммоний внутрь клетки, а сама соединяется с ним. На языке биологов, у нее появляются центры связывания высокой чувствительности. Соединение с аммонием в этих центрах приводит к изменению конфигурации белка в пространстве. Проще говоря, он начинает двигаться. Это изменение передается на гибко сочлененную с трансмембранной частью киназную часть и приводит к биохимической реакции - фосфорилированию аминокислотного остатка гистидина. Которая и является сигналом о присутствии аммония во внешней среде.
Пространственную структуру белков получают с помощью рассеяния рентгеновских лучей на молекулах исследуемого белка. Наиболее детальную информацию удается получить, если белок кристаллизовать, то есть уложить множество его молекул в кристаллическую решетку. Это приводит к радикальному усилению рассеянных лучей и более четкой картине. Однако, при работе с данным белком получение высококачественных кристаллов было существенно усложнено наличием гибкой двухкомпонентной системы. Внутренняя гибкость этого модульного белка оказалась серьезным препятствием для нахождения его структуры. Полную структуру удалось определить, лишь применив специальные математические подходы, разработанные в Институте математических проблем биологии для исследования структур плохо упорядоченных кристаллов.
Владимир Лунин, руководитель лаборатории кристаллографии макромолекул ИМПБ РАН: «Полученные кристаллы белка не позволяли определить структуру киназной части системы стандартными методами биологической кристаллографии. Мы применили математические методы, которые позволили распознать структуру и пространственную конфигурацию белка».